您现在的位置是: 首页 > 高考调剂 高考调剂
离子反应高考考点,高考离子反应的题
tamoadmin 2024-05-20 人已围观
简介1.两道高考化学题 希望大家帮忙解答以NaOH与Ca(HCO3)2反应为例,教你一种简单,实用的方法吧.像以上反应,遇到过量或不足时,不足的肯定要完全反应,过量的物质肯定有剩余。因此方程式肯定依据不足(量少)的来说书写,也就是“少定多变”,你先把少量的物质当做1mol 该物质在方程式中的计量数当做1.再考虑反应.如:过量的NaOH与Ca(HCO3)2反应. 则Ca(HCO3)2量不足,肯定完
1.两道高考化学题 希望大家帮忙解答
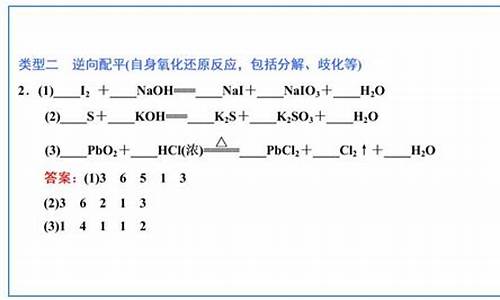
以NaOH与Ca(HCO3)2反应为例,
教你一种简单,实用的方法吧.
像以上反应,遇到过量或不足时,不足的肯定要完全反应,过量的物质肯定有剩余。因此方程式肯定依据不足(量少)的来说书写,也就是“少定多变”,你先把少量的物质当做1mol 该物质在方程式中的计量数当做1.再考虑反应.
如:过量的NaOH与Ca(HCO3)2反应.
则Ca(HCO3)2量不足,肯定完全反应,把Ca(HCO3)2当做1mol.那么1mol的Ca(HCO3)2就有1mol的Ca2+ 和2mol的HCO3- ,两种离子均要完全反应,反应时,就需要2mol的OH-也就是2mol的NaOH.即:2HCO3- + 2OH- = 2H2O + 2CO32-
生成的2mol的CO32-又与1mol的Ca2+反应生成1mol的CaCO3沉淀.
即:CO32- + Ca2+ = CaCO3↓
所以,反应的离子方程式写为:
2HCO3- + 2OH- + Ca2+ = CaCO3↓+ CO32-+2H2O
练习:少量的NaOH与足量的Ca(HCO3)2反应,
就把OH-当做1mol
反应的离子方程式:
就是实际可以分步理解,但一定要综合书写
练习:少量NaOH与Ca(HCO3)2
答案:OH- +HCO3- = CO32-+H2O 与CO32- + Ca2+ = CaCO3↓(分步理解)
因此方程式为:OH- + HCO3-+ Ca2+ = CaCO3↓+H2O
这类问题关键是理解,一旦理解了,以后一了百了,都好处理。类似练习
另有
往NaOH(aq)中滴入Ca(HCO3)2(aq)离子方程式,依上
OH-+HCO3-+Ca2+=CaCO3+H2O
往Ca(HCO3)2(aq)中滴入NaOH(aq)
2OH-+2HCO3-+Ca2+=CaCO3+CO32-+H2O
两道高考化学题 希望大家帮忙解答
一、所谓离子共存,实质上就是看离子间是否发生反应的问题。若在溶液中发生反应,就不能共存。看能否发生反应,不仅是因为有沉淀、气体、水、难电离的物质产生,还涉及到溶液酸碱性、有色、无色,能否进行氧化还原反应等。
一般注意以下几点:
①在强酸性溶液中,不能大量存在弱酸根离子:如碳酸根(CO3 2-)、碳酸氢根(HCO3 -)、硫离子(S 2-)、硫氢根离子(HS-)、亚硫酸根离子(SO3 2-)、硅酸根离子(SiO3 2-)、偏铝酸根离子(AlO2-)、氟离子(F-)等,也不能有大量的氢氧根(OH-)。
②强碱性溶液中,不能大量存在弱碱金属离子。如:镁离子(Mg2+)、亚铁离子(Fe2+)、铝离子(Al3+)、铜离子(Cu2+)及铵根离子(NH4+)等,也不能大量存在氢离子(H+)及酸式根离子:HCO3-、HSO3-、HS-、H2PO4-等。
③能发生氧化还原反应的离子也不能共存:如:Fe3+与I-,Cu2+与I-,H+Fe2+与NO3-,H+与SO32-,ClO-与S2-,ClO-与Fe2+,H+、I-与NO3-,H+、I-与SO32-或S2-等。
④能形成弱离子的也不能共存:如:Fe3+与SCN-,Ag+与SO32-,Fe3+与C6H5O-等。
以上内容简化为:
①强酸不存弱酸根 离子共存
②强碱不存弱碱金属
③氧化还原定不存
④成弱也不存
离子共存问题常见的典型问题 1. Al(OH)3有酸式电离和碱式电离:,增加或OH-、Al3+浓度;或者增加H+、AlO2-离子浓度,都可以使平衡朝生成沉淀的方向移动。因此OH-、Al3+;H+、AlO2-不能共存,但OH-、AlO2-;Al3+、H+可以共存。 2.Fe2+、NO3-可以共存,但有H+时不能共存,因为HNO3具有强氧化性。 3.某溶液与铝反应可以生成氢气,在该溶液中不一定存在与H+或者OH-可以共存的离子。 4.常温下,某溶液中由水电离出的H+为0.01mol/L,则该溶液可能是pH=2或者pH=12的溶液。该溶液为酸性或碱性,有H+或者OH-。 5.某种溶液中有多种阳离子,则阴离子一般有NO3-;某种溶液中有多种阴离子,一般阳离子有K+、Na+、NH4+中的一种或几种。 6.酸性条件下 ClO—与Cl—不共存 离子共存问题(高考热点) ⒈离子在溶液中能否大量共存首先应看其能否发生以下反应: ⑴能发生复分解反应,即能够形成沉淀、易挥发性物质(气体)、弱电解质(如水、弱酸、弱碱等)的离子不能大量共存。其中,微溶物如CaSO4等少量可以共存,大量不能共存。
二、酸化实际上考察的就是:共存时要考虑氢离子
还有什么问题吗?
1.把两溶液混合后,最终得到的溶液是醋酸和醋酸钠的混合溶液,溶液中存在的离子包括:CH3COO- (醋酸根,也用Ac-表示) OH- Na+ H+,
所以溶液中存在电荷守恒:c(Na+) + c(H+) = c(Ac-) + c(OH-)
现在,你明白氢离子浓度大于氢氧根,那么把c(H+) > c(OH-)代入上式,就很容易得到c(Ac-) > c(Na+)
钠离子与氢离子的大小,如你所言,反应前醋酸浓度是要比氢氧化钠大的,中和后,未电离的醋酸开始电离,现在的关键是“醋酸是弱电解质”,所以它的电离是非常有限的,所以得到的氢离子浓度还是相当低,不可能大于由“pH=11的氢氧化钠溶液电离出来的钠离子”。如果这个时候醋酸是强电解质,完成电离,那么氢离子才会大于钠离子。
2.题目给的条件“氧化性Cu2+ > I2"的目的就是让你来判断反应的生成物的。如果象你说的,反应是: Cu + 2HI = H2 + CuI2 ,那么得到的铜离子就会把I-氧化,得到I2: 2Cu2+ + 4I- = I2 + 2CuI
上一篇:高考状元出书_高考状元推荐的书