您现在的位置是: 首页 > 教育改革 教育改革
氧化还原反应高考题及解析,氧化还原高考题
tamoadmin 2024-05-23 人已围观
简介1.一道关于硫的高一化学题目。也是高考题目2.谁有有关元素周期表的大题目(8分)氧化还原(8分)有机合成推断(14,15分那种)3.2012年上海高考化学20题D选项怎么解释?4.一道05年化学高考题,急急急5.求解关于有机物的氧化还原反应方程式配平有什么技巧?6.下列微粒既有氧化性又有还原性的是: ...7.高考化学:离子反应和氧化还原反应先后顺序问题(1)氧化性:氯气&
1.一道关于硫的高一化学题目。也是高考题目
2.谁有有关元素周期表的大题目(8分)氧化还原(8分)有机合成推断(14,15分那种)
3.2012年上海高考化学20题D选项怎么解释?
4.一道05年化学高考题,急急急
5.求解关于有机物的氧化还原反应方程式配平有什么技巧?
6.下列微粒既有氧化性又有还原性的是: ...
7.高考化学:离子反应和氧化还原反应先后顺序问题
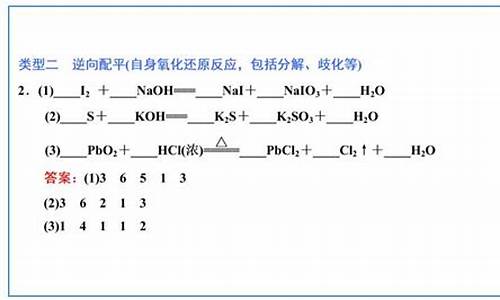
(1)氧化性:氯气>3价铁离子>碘
还原性:碘离子>2价铁离子>氯离子
氧化碘离子而不能氧化2价铁离子那就只能用3价铁离子了,若用氯气则要把2价铁离子也可氧化了,
(2)氧化性:高锰酸根离子>3价铁离子>碘
还原性:碘离子>2价铁离子
故若有碘离子必不存在3价铁离子和高锰酸根离子
必有2价铁离子
一道关于硫的高一化学题目。也是高考题目
计算题中的判断
某金属单质跟一定浓度的硝酸反应,假定只产生单一的还原产物,当参加反应的单质与被还原硝酸的物质的量之比为2:1时,还原产物是(1997年全国高考题)
A.NO2
B.NO
C.N2O
D.N2
思路分析:根据氧化还原反应中得失电子数守恒,即可求出硝酸还原后的价态,即可确定产物的分子式。
设金属的化合价为X,还原产物中N的价态为Y,则有:
2X=1×(5-Y),Y=5-2X。讨论:X=1,Y=3(为N2O3);X=2,Y=1(N2O);X=3,Y=-1(舍)。
答案:C
方法要领:这类题的关键是看硝酸作用。若为某非金属单质与硝酸发生氧化还原反应时,参加反应的硝酸只作氧化剂;若为金属与硝酸反应,作氧化剂的硝酸的量:总量减去产物阳离子结合掉的硝酸根的量。此时特别注意硝酸当还原产物中N的价态-3价时,还应再减去生成硝酸铵中的硝酸根的量。
一般方法:
一般来说,浓硝酸的还原产物主要是
NO2,稀硝酸的还原产物主要是
NO
和N2O,更稀的硝酸甚至可以还原为
N2
谁有有关元素周期表的大题目(8分)氧化还原(8分)有机合成推断(14,15分那种)
A中,硫酸中和掉NaOH后剩下的还有N2和O2,干扰结果;
B酸性高锰酸钾有强氧化性,会将SO2氧化从而褪色,稀硫酸用来酸化的;
C是利用了SO2的还原性,将碘还原,从颜色判断;
D可以从第一小题看出,SO3会干扰结果。
2012年上海高考化学20题D选项怎么解释?
一、以元素周期表周期律为背景的大题试题
1.阅读下面的信息,推断元素及有关物质,按要求回答物质:
信息①:X、Y、Z、W是常见的短周期元素,其原子序数依次增大,且原子核外最外层电子数均不少于2。
(1)根据信息①:X一定不是 (填序号).
A.氢 B. 碳 C. 氧 D. 硫
信息②:上述四种元素的单质均能在足量的氧气中燃烧,生成的四种氧化物中,有两种能溶于稀硫酸,三种能溶于浓氢氧化钠溶液,氧化物的相对分子质量都大于26。
(2)这四种元素中是否可能有一种是铝元素? 。
信息③:向上述四种元素单质组成的混合物中加入足量盐酸溶液,固体部分溶解,过滤,向滤液中加入过量的烧碱溶液,最终溶液中析出白色沉淀。
(3)白色沉淀物的化学式为 。
信息④:向上述四种元素单质组成的混合物中加入足量烧碱溶液,固体部分溶解,过滤,向滤液中加入过量的盐酸溶液,最终溶液中析出白色沉淀。
(4)生成白色沉淀物的离子方程式为 。
信息⑤:X与W同主族
(5)X与浓硫酸加热时反应的化学方程式为 。
答案:
(1)A. D--------------------------------------------------------------------(共2分,有错误答案不记分)
(2)可能----------------------------------------------------------------------------------------------(共1分)
(3)Mg(OH)2 ----------------------------------------------------------------------------------(-共2分)
(4)SiO32—+2H++H2O=H4SiO4↓或SiO32—+2H+ =H2SiO3↓-------------------------------(共2分)
(5)C+2H2SO4(浓) CO2↑+2SO2↑+2H2O------------------------------------------(共2分)
2. A、B、C、D均为短周期不同主族的元素,分别属于三个不同的周期且原子序数依次增大。A、C可形成原子个数比分别为1∶1和2∶1的两种化合物。A与B能形成一种使湿润红石蕊试纸变蓝的气体X,A与D能形成酸性气体Y。A、B、C能形成一种离子化合物,其水溶液成弱酸性,请写出:
(1)D的元素符号为 ,X极易溶于水的原因是 ,X跟Y反应的化学方程式为 ,A、C形成的原子个数比为1∶1的化合物的电子式为 ,它是 (极性/非极性)分子。
(2)用化学用语解释A、B、C形成的化合物水溶液呈弱酸性的原因是 。
(3)铋(Bi)跟D元素能形成化合物(BiD3),其水解生成难溶于水的(BiOD)。
①BiD3水解反应的化学方程式为 。
②把适量的BiD3溶于含有少量Y的水中,能得到澄清溶液,试分析可能的原因。
。
③医药上把BiOD叫做“次某酸铋”,分析这种叫法是否合理? 。若认为不合理,请说明理由, 。(若认为合理,此空可不作答)。
答案:(1)Cl(1分)、氨易与水形成氢键(2分)、NH3 + HCl=NH4Cl(2分)、H O O H(2分) 、极性(1分) (2)NH4++H2O NH3?H2O+H+(2分)
(3)①BiCl3+ H2O BiOCl+2HCl(2分) ②盐酸抑制BiCl3水解(2分) ③不合理(1分) BiOCl中的Cl为-1价,不是+1价。(2分)
3.W、X、Y、Z是原子序数依次增大的同一短同期元素,W、X是金属元素,Y、Z是非金属元素。
(1)W、X各自的最高价氧化物对应的水化物可以反应生盐和水,该反应的离子方程式为____________________。
(2)W与Y 可形成化合物W2Y,该化合物的电子式为______________。
(3)X的硝酸盐水溶 液显______性,用离子方程式解释原因____________________________。
(4)Y的低价氧化物通入Z单质的水溶液中,发生反应的化学方程式为____________________。
(5)比较Y、Z气态氢化物的稳 定性_____>_______(用分子式表示)
(6)W、X、Y、Z四种元素简单离子的离子半径由大到小的顺序是:_____>_____>______>______。
(7)Z的最高价氧化物为无色液体,0.25 mol该物质与一定量水混合得到一种稀溶 液,并放出QkJ的热量。写出该反应的热化学方程式:_______________________。
答案:
(1)Al(OH)3+OH-=AlO2-+2H2O(2)
(3)酸 Al3++3H2O Al(OH)3+3H+
(4)SO2+Cl2+2H2O=H2SO4+ 2HCl
(5)HCl>H2S(6)Cl2O7(l)+H2O(l)=2HClO4(aq) △H=-4QkJmol-1
4.根据周期表对角线法则,金属Be和Al单质及化合物性质相似,又知AlCl3的熔沸点低,容易升华。试回答下列问题:
(1)写出Be和氢氧化钠反应生成Na2BeO2的离子方程式: 。
(2)Be(OH)2和Mg(OH)2可以用: 试剂鉴别,其离子方程式为: 。
(3)BeCl2是: (填离子或共价)化合物,推测BeCl2水溶液在常温下的pH: 7(填“大于“等于”“小于”)。
(4)Li和Mg根据对角线法则,性质也相似,Li在空气中燃烧,主要产物的化学式为: 同时还有少量的: 生成。
(5)工业上冶炼铝的原理是: 铝和氢氧化钠溶液反应的离子方程
式为: 向铝和氢氧化钠溶液反应的溶液中通入过量的CO2,反应的离子方程式为: 。
答案:(1)Be+2OH—=BeO22—+H2↑(2)氢氧化钠溶液 Be(OH)2+2OH—=BeO22—+2H2O
(3) 共价 小于 (4)Li2O Li3N (5)电解融化状态的氧化铝
2Al+2OH—+2H2O=2AlO2—+3H2↑ AlO2—+CO2+2H2O=Al(OH)3+HCO3—
5.X、Y、Z为三个不同短周期非金属元素的单质。在一定条件下有如下反应:Y+X→A(气),Y+Z→B(气)。请针对以下两种不同情况回答:
(1)若常温下X、Y、Z均为气体,且A和B化合生成固体C时有白烟产生,则:
①Y的化学式是 ;
②生成固体C的化学方程式是 。
(2)若常温下Y为固体,X、Z为气体,A在空气中充分燃烧可生成B,则:
①B的化学式是 ;
②向苛性钠溶液中通入过量的A,所发生反应的离子方程式是 ;
③将Y与(1)中某单质的水溶液充分反应可生成两种强酸,该反应的化学方程式是
。
答案:.(1) ①H2 ② NH3 + HCl == NH4Cl
(2) ① SO2 ② H2S + OH- == HS- + H2O
③ S+3Cl2 + 4H2O == H2SO4 + 6HCl
二、氧化还原的题
例1 下列叙述正确的是( )
A.在氧化还原反应中,非金属单质一定是氧化剂
B.氧化还原反应的本质是电子的转移
C.还原剂在反应中发生还原反应
D.有单质生成的反应一定是氧化还原反应
解析:本题是关于氧化还原反应概念的正误判断题,解答时要正确理解有关概念的内涵与外延,注意区分易混淆的概念。在氧化还原反应中,非金属单质既可以作氧化剂,又可以作还原剂。比如在S+O2====SO2的反应中,S、O2均为非金属,前者是还原剂,后者是氧化剂,A项错误;还原剂在化学反应中失去电子,发生氧化反应,被氧化;氧化剂在化学反应中得到电子,发生还原反应,被还原,C项错误;有单质生成的反应不一定是氧化还原反应,如3O2====3O3即为非氧化还原反应,D项错误。
答案:B
例2 (2006江苏,3) 物质氧化性、还原性的强弱,不仅与物质的结构有关,还与物质的浓度和反应温度等有关。下列各组物质:
①Cu与HNO3溶液 ②Cu与FeCl3溶液 ③Zn与H2SO4溶液 ④Fe与HCl溶液
由于浓度不同而能发生不同氧化还原反应的是( )
A.①③ B.③④ C.①② D.①③④
解析:本题主要考查影响物质氧化性或还原性强弱的因素。Cu与浓硝酸作用生成Cu(NO3)2、NO2和H2O,而Cu与稀HNO3作用时则生成Cu(NO3)2、NO和H2O;Cu与FeCl3溶液反应只生成CuCl2和FeCl2;Zn与H2SO4反应则有如下两种情况:Zn+H2SO4(稀)====ZnSO4+H2↑,Zn+2H2SO4(浓)====ZnSO4+SO4↑+2H2O;Fe与盐酸反应时只生成FeCl2和H2。由以上分析可知HNO3、H2SO4浓度不同,其氧化性强弱不同,发生的氧化还原反应不同。
答案:A
例3 (1)在反应2KMnO4+16HBr====5Br2+2MnBr2+2KBr+8H2O中,还原剂是_________。
(2)已知BrFx与H2O按物质的量之比3∶5反应的产物是HF、HBrO3、Br2、O2,该反应中的氧化剂是__________,还原剂是__________,BrFx中的x=__________。
(3)浓盐酸在反应KClO3+HClKCl+ClO2+Cl2+□中显示出来的性质是______________。
(4)在一定条件下,PbO2与Cr3+反应,产物是和Pb2+,则与1 mol Cr3+反应所需PbO2的物质的量为_______________。
解析:这是一道将近年高考题进行组合、改编而成的考查氧化剂、还原剂、盐酸在反应中扮演的角色以及氧化还原反应的典型计算等基础知识的试题。
(1)HBr被氧化成Br2,HBr是还原剂。
(2)依题意写出化学方程式:
3BrFx+5H2O====HBrO3+Br2+O2+3xHF
可确定x=3,氧化剂是BrF3,还原剂是BrF3、H2O。
(3)酸性(生成KCl和H2O)和还原性(被氧化成Cl2)。
(4)由题意可知,铅元素由+4价变为+2价,铬元素由+3价变为+6价。设所需PbO2的物质的量为x,则有(6-3)×1 mol=(4-2)x,解得x=1.5 mol。
答案:(1)HBr (2)BrF3 BrF3、H2O 3 (3)1 H2O 酸性和还原性 (4)1.5 mol
链接·提示
氧化还原反应计算的核心是守恒——原子个数、得失电子、正负电荷守恒。追踪元素变化,把握守恒关系列等式,是解题的一般思路。
例4(2006上海,24) (1)请将5种物质:N2O、FeSO4、Fe(NO3)3、HNO3和Fe(SO4)3分别填入下面对应的横线上,组成一个未配平的化学方程式。
_________+_________→_________+_________+_________+H2O
(2)反应物中发生氧化反应的物质是_________,被还原的元素是_________。
(3)反应中1 mol氧化剂_________ (填“得到”或“失去”) _________mol电子。
(4)请将反应物的化学式及配平后的化学计量数填入下列相应的位置中:
□_________+□_________→
解析:本题综合考查氧化还原反应的概念、常见氧化剂、还原剂的判定、氧化还原反应方程式的书写及配平。由题给定的物质中,HNO3常作氧化剂,FeSO4常作还原剂。在HNO3与FeSO4发生的氧化还原反应中,FeSO4中的铁元素化合价升高被氧化,生成Fe2(SO4)3;和Fe(NO3)3;HNO3中的氮元素由+5价降低为+1价,生成N2O,氮元素被还原,1 mol HNO3应得到4 mol电子。用化合价升降法配平得下列方程式:
24FeSO4+30HNO3====8Fe(NO3)3+8Fe2(SO4)3+3N2O+5H2O
答案:(1)FeSO4+HNO3Fe(NO3)3+Fe2(SO4)3+N2O+H2O
(2)FeSO4 N
(3)得到 4
(4)24FeSO4+30HNO3
例5 用含有①Fe3+ ②I- ③I2 ④H2S的四种溶液进行如下实验:
(1)将②和③混合后再加入①,反应后溶液中有Fe3+,则溶液中还有________离子,没有________离子。
(2)将②和③混合后再加入④,反应后溶液中没有I2,则溶液中肯定有________离子,可能有________离子。
(3)取①的酸性溶液和④混合,反应的离子方程式是________________________。
解析:(1)发生的反应为:2Fe3++2I-=====2Fe2++I2,反应后溶液中有Fe3+,一定还有Fe2+,没有I-。
(2)发生的反应为:I2+H2S====2HI+S↓,溶液中肯定有I-、H+,可能有S2-、HS-。
答案:(1)Fe2+ I- (2)I-、H+ S2-、HS- (3)2Fe3++H2S====2Fe2++S↓+2H+
三、有机合成与推断:(抱歉,粘不下了,去看看吧!) style="font-size: 18px;font-weight: bold;border-left: 4px solid #a10d00;margin: 10px 0px 15px 0px;padding: 10px 0 10px 20px;background: #f1dada;">一道05年化学高考题,急急急
A,选项,因为S从-2价到SO2中的+4价,化合价升高,被氧化,所以SO2是氧化产物,而作为氧化剂的O2中的O元素,从单质的0价到SO2中的-2价,化合价降低,被还原,所以SO2又是还原产物,所以A正确。一个是对于S元素来说,另一个是对O元素来说的。
D选项,也正确,因为这个反应中,唯一被氧化的是后来转化为SO2的相对应的CuFeS2中的部分S元素,而且,从方程式可知,被氧化的S,即化合价升高的S,占总的S元素的1/4。而S从原来的-2价到SO2中的+4价,失去(转移)了6个电子,因此,每转移1.2mol电子,生成的SO2就有1.2/6=0.2mol,即有0.2mol硫S被氧化。
而C选项,从以上分析,以及化学方程式的系数可知,每生成1mol的Cu2S,同时就生成1mol的SO2,因此就只有1mol的硫S被氧化,所以,C选项错误。
所以,正确选项为A,D。
望采纳!谢谢!
求解关于有机物的氧化还原反应方程式配平有什么技巧?
由题意,氧化性:Co2O3>Cl2>Fe3+>I2,所以还原性:Co2+<Cl-<Fe2+<I-。
根据氧化还原反应的优先律,一种氧化剂与两种还原剂相遇时,还原性强的优先被氧化,故I-先被Cl2氧化为I2,而不是Fe2+先被氧化为Fe3+;并且氧化性强的Fe3+不能与还原性强的I-共存,Fe3+会将I-氧化成I2,发生选项D的反应。所以A错B对。
B项是在Cl2不足量而FeI2过量的情况下发生的反应,如果Cl2足量的话,Fe2+就会被氧化成Fe3+了:3Cl2+2FeI2=2FeCl3+2I2
C项氧化性Co2O3>Cl2,还原性Cl->Co2+,因此反应可以发生,故C项正确。这个反应类似于MnO2与浓盐酸制取氯气的反应,氧化性MnO2>Cl2。
D项氧化性Fe3+>I2,还原性I->Fe2+,故D项正确
下列微粒既有氧化性又有还原性的是: ...
氧化剂、还原剂中某元素化合价全变的反应,一般从反应物着手配平。如91年高考题:
Pt+HNO3+HCl-H2PtCl6+NO↑+H2O
分析:还原剂Pt和氧化剂HNO3中N的化合价全变,可从反应物着手先确定Pt和HNO3的系数。
确定了Pt和HNO3的系数分别为3和4之后,再用观察法配平其余物质的系数,得到:
3Pt+4HNO3+18HCl=3H2PtCl6+4NO↑+8H2O;
自身氧化还原反应(包括同一物质中同种元素变价和不同种元素变价两种情况),一般从生成物着手较好。如92年高考试题:
(NH4)2PtCl6Pt+NH4Cl+HCl↑+N2↑
分析:该反应是(NH4)2PtCl6中N与Pt之间发生的自身氧化还原反应,可从生成物着手,先确定Pt和N2的系数。
确定了Pt和N2的系数分别为3和2之后,再用观察法配平其余物质的系数,可得:
3(NH4)2PtCl6==3Pt+2NH4Cl+16HCl↑+2N2↑;
部分变两边配 ,如85年高考题:
Zn+HNO3——Zn(NO3)2+NH4NO3+H2O
分析:该反应中HNO3部分被还原,其系数应为变与不变之和。对于这类部分氧化还原反应,宜从反应物和生成物同时着手,先确定Zn和NH4NO3的系数。
确定了Zn和NH4NO3的系数分别为4和1之后,再用观察法配平Zn(NO3)2、HNO3、H2O的系数依次为4、10、3;
多变要整体配,如89年高考题:
Cu2S+HNO3——Cu(NO3)2+NO↑+H2SO4+H2O
分析:Cu2S中的Cu和S同时失去电子,应从反应物着手,把Cu2S当作一个整体来处理。
确定了Cu2S和NO的系数分别为3和10之后,再用观察法确定H2SO4、Cu(NO3)2、HNO3、H2O的系数依次为3∶6、22、8;
化台价难断用整体总价法配,如1991年河南省化学奥林匹克竞赛决赛试题:
Fe3P+HNO3——Fe(NO3)3+NO↑+H3PO4+H2O
分析:Fe3P中元素化合价难以断定,以整体记为[Fe3P]0,则:
确定了Fe3P和NO的系数分别为3和14之后,再用观察法确定H3PO4,Fe(NO3)3、NO、HNO3、H2O的系数依次为3、9、14、41、16。
高考化学:离子反应和氧化还原反应先后顺序问题
| B |
| 试题分析:化合价处于中间价态的微粒既有氧化性又有还原性,B正确;氢离子、铜离子只有氧化性,金属铝只有还原性,答案选B。 点评:该题是基础性试题的考查,也是高考中的常见考点。试题基础性强,主要是考查学生对氧化性、还原性判断的熟悉了解程度,有利于培养学生的逻辑推理能力,也有助于提高学生灵活运用基础知识解决实际问题的能力。 |
反应物间一对多的化学反应常有“平行反应”和“竞争反应”两类,平行反应主要指多个反应相互间没有影响可同时进行;而竞争反应是指由于反应能力不同,多个反应按一定的先后顺序逐次进行。
竞争反应主要包括两种基本题型:?
一是一种氧化剂(还原剂)与多种还原剂(氧化剂)反应,如把Cl2通入含I-、Br-、Fe2+的溶液中,按照还原能力由强到弱的顺序,I-优先反应,其次是Fe2+,最后是Br-;?
二是一种酸(碱)与多种碱性(酸性)物质反应,如把盐酸逐滴加入到含有NaOH、Na2CO3、NaHCO3的混合溶液中,按照碱性由强到弱的顺序,NaOH优先反应,其次是Na2CO3,最后是NaHCO3,
此类竞争反应的先后顺序即是其有效顺序。在实际问题中有部分看似平行的反应,由于物质的性质而出现了“有效”和“无效”两种可能性,准确地确定有效反应就成了解题的关键。
解决此类问题最简单的方法就是假设法
1.?复分解反应之间的竞争?
若某一溶液中同时存在几个可能的复分解反应,则生成更难溶解或更难电离的物质的反应将优先进行。
例1?写出在硫酸铝铵溶液中加入少量氢氧化钡溶液的离子方程式:______________。
解析:假设NH4+与OH-先反应,则生生NH3?H2O,而Al3+又与NH3?H2O反应生成NH4+和2Al(OH)3,故认为是Al3+和OH-先反应。
在硫酸铝铵溶液中,存在NH4+、Al3+与SO42-,当加入少量的Ba(OH)2溶液后,Ba2+和SO42-结合生成BaSO4,OH-则既可与Al3+结合又能与NH结合,它们彼此之间发生相互竞争的反应。由于在含有Al3+的溶液中滴入NH3·H2O,有白色沉淀生成可知,Al3+结合OH-的能力大于NH4+结合OH-的能力,OH-优先与Al3+结合生成Al(OH)3,则上述离子方程式为2Al3++3SO42-+3Ba2++6OH-===2Al(OH)3↓+3BaSO4↓。
答案: 2Al3++3SO42-+3Ba2++6OH-===2Al(OH)3↓+3BaSO4↓
即时巩固
1 少量NaOH溶液滴入到NH4HCO3溶液中的离子方程式为______________。
答案:HCO3-+OH-===H2O+CO32-
即时巩固
2 向NH4Cl、AlCl3、MgCl2混合溶液中逐滴加入NaOH溶液至过量,按反应的先后顺序,写出有关反应的离子方程式:
(1)__________________________________________。
(2)____________________________________。
(3)___________________________________。
答案:(1)Al3++3OH-===Al(OH)3↓、Mg2++2OH-===Mg(OH)2↓
(2)NH4++OH-===NH3·H2O
(3)Al(OH)3+OH-===AlO2-+2H2O
2.?氧化还原反应之间的竞争
若某一溶液中同时含有多种还原性(氧化性)物质,则加入一种氧化剂(还原剂)时,优先氧化(还原)还原性(氧化性)强的物质。
例2 在含有Cu(NO3)2、Zn(NO3)2、Fe(NO3)3、AgNO3各0.01 mol?的酸性混合溶液中加入0.01 mol铁粉,经搅拌后发生的变化应是?(? )
A.铁溶解,析出0.01 mol Ag和0.005 mol Cu
B.铁溶解,析出0.01 mol Ag并放出H2?
C.铁溶解,析出0.01 mol Ag,溶液中不再有Fe3+?
D.铁溶解,析出0.01 mol Ag,溶液中不再有Cu2+
解析 因为氧化性Ag+>Fe3+>Cu2+>H+,所以先发生反应2Ag++Fe===2Ag+Fe2+,其中0.005 mol的铁粉与0.01 mol 的AgNO3反应,析出0.01 mol Ag,再发生:2Fe3++Fe==3Fe2+,其中剩余的0.005 mol铁粉与0.01 mol的Fe(NO3)3反应,溶液中不再有Fe3+,故选C。
答案 C?
即时巩固
3 将足量Cl2缓缓通入含0.02 mol H2SO3和0.02 mol HBr的混合溶液中。在此过程中溶液的pH与Cl2用量的关系示意图是(溶液体积变化忽略不计,且不考虑Cl2与水反应)(? )
?
答案A
解析 因H2SO3的还原性强于HBr的还原性,故Cl2先氧化H2SO3,H2SO3+Cl2+H2O===H2SO4+2HCl,生成的H2SO4和HCl均是强酸,故溶液的pH下降;当H2SO3完全反应后,再通入Cl2,发生反应Cl2+2HBr===Br2+2HCl,溶液的pH不再改变。
即时巩固
4?向NaBr、NaI和Na2SO3混合液中通入一定量氯气后,将溶液蒸干并充分灼烧,得到固体物质的组成可能是(? )
A.NaCl、Na2SO4?B.NaBr、Na2SO4?
C.NaCl、Na2SO4、I2D.NaCl、NaI、Na2SO4
答案 A
解析 向NaBr、NaI和Na2SO3混合液中通入一定量氯气后,可能发生的反应依次为Na2SO3+Cl2+H2O===Na2SO4+2HCl、2NaI+Cl2===2NaCl+I2、2NaBr+Cl2===2NaCl+Br2。将溶液蒸干时HCl、Br2和Cl2会挥发,灼烧时I2会升华。若通入的氯气过量,得到固体剩余物质的组成是NACl、Na2SO4;若通入的氯气是不足量的,则还有可能留下NaBr。
即时巩固
5 某稀溶液中含有Fe(NO3)3、Cu(NO3)2和HNO3,若向其中逐渐加入铁粉,溶液中Fe2+的浓度和加入铁粉的物质的量之间的关系如下图所示。则稀溶液中Fe(NO3)3、Cu(NO3)2、HNO3的物质的量浓度之比为
?答案1∶1∶4
解析 氧化性由强到弱的顺序是HNO3>Fe3+>Cu2+,反应由先到后的顺序为
4HNO3+Fe===Fe(NO3)3+NO↑+2H2O?
4mol?1 mol?1 mol
2Fe3++Fe===3Fe2+?
2 mol?1 mol?3 mol
故原溶液中n[Fe(NO3)3]=2 mol-1 mol=1 mol
Cu2++Fe===Fe2++Cu
1 mol?1 mol?1 mol
故c[Fe(NO3)3]∶c[Cu(NO3)2]∶c(HNO3)=1∶1∶4。
3.?氧化还原反应与非氧化还原反应之间的竞争
一般情况下,氧化还原反应优先于非氧化还原反应发生。
例3 写出向漂白粉溶液中通入二氧化硫气体的化学方程式。
解析 漂白粉溶液中含有CaCl2和Ca(ClO)2,其中Ca(ClO)2水溶液能与SO2发生反应,向漂白粉溶液中通入二氧化硫气体后,是发生复分解反应生成CaSO3和HClO还是发生氧化还原反应,两反应相互竞争。由于次氯酸盐及次氯酸都具有强氧化性而亚硫酸盐及二氧化硫都具有还原性,所以是发生氧化还原反应而不是复分解反应。
答案 Ca(ClO)2+2SO2+2H2O===CaSO4↓+2HCl+H2SO4
即时巩固?
6?往含Fe3+、H+、NO3-的混合液中加入少量SO2,充分反应后,下列表示该反应的离子方程式正确的是(? )
A.2Fe3++SO2+H2O===2Fe2++SO42-+2H+
B.2H++SO32-===H2O+SO2↑
C.2H++2NO3-+3SO2===3SO42-+2NO↑+H2O?
D.2Fe3++3SO32-+3H2O===2Fe(OH)3↓+3SO2↑
答案 C?
解析 此题看上去似乎4个选项都可能发生,但我们知道氧化还原反应优先于非氧化还原反应,因此B、D不正确。那么SO2是先与Fe3+反应还是先与H++NO3-反应呢?可以用“假设法”进行判断。如果先与Fe3+反应,则生成的Fe2+又会与H++NO3-反应,所以应先与H++NO3-反应,故应选C。
即时巩固
7 写出下列反应的离子方程式:
(1)FeCl2溶液与NaClO溶液反应__________________。?
(2)Na2S与FeCl3溶液混合______________________。?
(3)硫化钠与CuSO4溶液混合___________________。
答案:
(1)6Fe2++3ClO-+3H2O===2Fe(OH)3↓+3Cl-+4Fe3+
(2)2Fe3+S2-===2Fe2++S↓
(3)Cu2+S2-===CuS↓?
解析: ?
(1)氯化亚铁是强酸弱碱盐且有还原性,次氯酸钠是强碱弱酸盐且有氧化性,两者相遇既可发生双水解反应又可发生氧化还原反应,两反应相互竞争,由于发生氧化还原反应可以使溶液中离子浓度大大降低,所以优先发生氧化还原反应。
(2)硫化钠与氯化铁相遇,可能发生复分解反应、双水解反应及氧化还原反应,若发生复分解反应则生成Fe2S3,由于Fe2S3在水溶液中不存在,故不能发生复分解反应,也不可能在溶液中发生双水解反应,因Fe3+具有氧化性,S2-具有还原性,所以硫化钠与氯化铁发生的是氧化还原反应。?
(3)由于Cu2+的氧化性较弱,Cu2+和S2-不易发生氧化还原反应。硫化钠与硫酸铜可能发生双水解反应、复分解反应,两反应互相竞争。由于CuS在水中的溶解度远远小于Cu(OH)2的溶解度,则硫化钠与硫酸铜发生的是复分解反应而不是双水解反应。