您现在的位置是: 首页 > 教育政策 教育政策
高考杂化轨道_高三化学杂化轨道
tamoadmin 2024-05-16 人已围观
简介首先知道P轨道是有方向的x、y、z只有同方向的轨道才能重合形成π键氧原子P轨道上有两个孤电子一个与S的sp2杂化轨道形成σ键那另一个应该形成离域π键啊S的sp2轨道有3个电子价上氧的一共6个形成离域π键至于Cu2+为什么只接受4个H2O分子中O原子提供的孤电子对而不是小于4或大于4 也与中心的杂化方式有关超出高中范围如dsp2就是平面型4配体d2sp3sp3d2是八面体型6配体等等还有确定是AlF
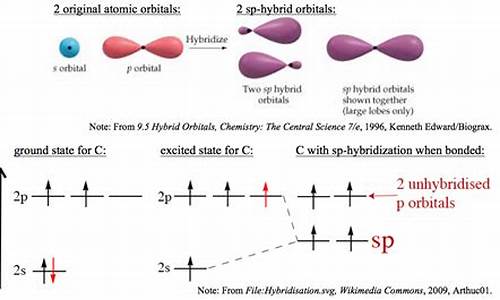
首先知道
P轨道是有方向的
x、y、z
只有同方向的轨道才能重合形成π键
氧原子P轨道上有两个孤电子
一个与S的sp2杂化轨道形成σ键
那另一个应该形成离域π键啊
S的sp2轨道有3个电子
价上氧的
一共6个
形成离域π键
至于Cu2+为什么只接受4个H2O分子中O原子提供的孤电子对而不是小于4或大于4
也与中心的杂化方式有关
超出高中范围
如dsp2就是平面型4配体
d2sp3
sp3d2是八面体型6配体等等
还有
确定是AlF5?如果是
是不是F原子间存在化学键?
VSEPR模型需要确定中心原子
电子式的局限性也很大
比如SF6的正八面体构型能用VSEPR理论解释
不过怎样画电子式?应该不能
选修3的课本知识的确少
但是理论性强
想要学明白需要很强的能力
很多的功夫
如果深挖
涉及很多大学内容
竞赛用得上
建议看下大学教材
不过高考考查的内容很简单
Na[Al(OH)4],没有大π键,其中[Al(OH)4]-离子中有1个OH-以配位键(Al提供p轨道,O提供孤对电子)的形式与中心离子Al3+络合。Al提供的是一条s轨道和3条p轨道,采用的是sp3杂化(配体不是一个羟基 而是四个)所以每个氧原子提供1对电子,Al的sp3杂化轨道被填满。
形成大π键的条件
①这些原子都在同一平面上;②这些原子有相互平行的p轨道;③p轨道上的电子总数小于p轨道数的2倍。苯的分子结构是六个碳原子都以sp2杂化轨道结合成一个处于同一平面的正六边形,每个碳原子上余下的未参加杂化的p轨道,由于都处于垂直于苯分子形成的平面而平行,因此所有p轨道之间,都可以相互重叠而形成。
无机化合物中也存在这样的π键,例如:co2(二氧化碳)的中心原子c采取sp杂化(两条不满的p轨道),而且氧原子也有不成对的p电子,这三个原子中就在两个方向上形成了各有四个电子的两个离域π键。
不一定是端基,和非杂化原子才能形成大π键
上一篇:高考年龄山西,山西参加高考
下一篇:卡方题型,卡方的高考题









