您现在的位置是: 首页 > 教育分析 教育分析
高考化学计算题专题,化学小高考计算题
tamoadmin 2024-05-19 人已围观
简介解:常温下,PH=8的NaOH溶液浓度为10^-6mol/L,(离子积常数为10^-14)PH=4的硫酸浓度为1/210^-4mol/L反应后PH=7,即是中性,那么H+恰好和OH-反应完,2NaOH~H2SO42mol1mola10^-6b1/210^-4所以a:b=100:1道理相同,只是离子积常数变了,此时NaOH浓度为10^-4mol/L,硫酸不变,PH=7,此时溶液为碱性,反应后NaOH
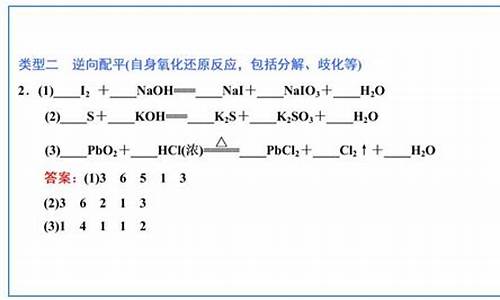
解:
常温下,PH=8的NaOH溶液浓度为10^-6
mol/L,(离子积常数为
10^-14)
PH=4的硫酸浓度为1/2×10^-4
mol/L
反应后PH=7,即是中性,那么
H+恰好和OH-反应完,
2NaOH
~
H2SO4
2
mol
1mol
a×10^-6
b×1/2×10^-4
所以a:b=100:1
道理相同,只是离子积常数变了,此时
NaOH浓度为
10^-4
mol/L,
硫酸不变,PH=7,此时溶液为碱性,
反应后NaOH
浓度为10^-5mol/L
因为反应后的溶液体积为两溶液体积和,所以反应掉的NaOH物质的量为n=a*10^-4-(a+b)*10^-5
2NaOH
~
H2SO4
2
1
n
b*1/2*10^-4
解出a:b=11:9
现在高考很少直接考氧化还原的计算题,一般都是在选择和填空中有相应计算。
以下仅作参考:
1.对于反应KMnO4+HCl→KCl+MnCl2+Cl2+H2O(未配平),若有0.1mol KMnO4参加反应,下列说法正确的是( )
A.其转移电子0.5mol B.生成Cl20.5mol
C.参加反应HCl为16mol D.Cl2是还原产物
解析配平该方程式为:2KMnO4+16HCl==2KCl+2MnCl2+5Cl2+8H2O ,Mn由+7→+2,得到5电子,则0.1mol KMnO4参加反应消耗HCl为1.6mol,转移的电子为0.5mol,生成的Cl2为0.25mol,故A正确,B、C不正确;Cl2是氧化产物,故D不正确。
答案A
2.在一定条件下,分别以高锰酸钾、氯酸钾、过氧化氢为原料制取氧气,当制得同温、同压下相同体积的氧气时,三个反应中转移的电子数之比为( )
A.l∶1∶1 B.2∶2∶1 C.2∶3∶1 D.4∶3∶2
解析用高锰酸钾、氯酸钾制氧气,反应过程中O由-2价转化为0价,而用过氧化氢制氧气,O则由-1价转化为0价。现要制得相同的O2,所以用过氧化氢制氧气的反应中转移的电子数只有用高锰酸钾、氯酸钾制取的反应中转移的电子数的一半。
答案B
3.锌与很稀的硝酸反应生成硝酸锌、硝酸铵和水.当生成1 mol 硝酸锌时,被还原的硝酸的物质的量为 ( )
A.2 mol B.1 mol C.0.5 mol D.0.25 mol
解析反应中Zn失电子变为+2价的Zn2+,HNO3得电子变为-3价的NH+4,故根 据得失电子守恒知产物硝酸锌与硝酸铵的物质的量之比为4∶1,故被还原的硝酸的物质的量为0.25 mol。
答案D
4.氮化铝(AlN,Al和N的相对原子质量分别为27和14)广泛应用于电子、陶瓷等工业领域.在一定条件下,AlN可通过反应Al2O3+N2+3C=====高温2AlN+3CO合成.下列叙述正确的是( )
A.上述反应中,N2是还原剂,Al2O3是氧化剂
B.上述反应中,每生成1 mol AlN需转移3 mol 电子
C.AlN中氮元素的化合价为+3价
D.AlN的摩尔质量为41 g
解析反应中氮元素由0价→-3价,碳元素由0价→+2 价,所以N2是氧化剂,C是还原剂,每生成1 mol AlN转移3 mol 电子,D项摩尔质量单位为g/mol。
答案B
5.某反应体系的物质有:NaOH、Au2O3、Na2S4O6、Na2S2O3、Au2O、H2O。
(1)请将Au2O3之外的反应物与生成物分别填入以下空格内。
Au2O3+ + ―→ + +
(2)反应中,被还原的元素是________,还原剂是________。
(3)将氧化剂与还原剂填入空格中,并标出电子转移的方向和数目。
+ +……
(4)纺织工业中常用氯气作漂白剂,Na2S2O3可作为漂白后布匹“脱氯剂”,Na2S2O3和Cl2反应的产物是H2SO4、NaCl和HCl,则还原剂与氧化剂物质的量之比为:________。
解析因为Au2O3为反应物,则Au2O必定为生成物,在Au2O3中Au的化合价为+3价,Au2O中Au的化合价为+1价,即Au在反应中化合价降低,则另一种元素的化合价必定升高,在Na2S2O3中S的化合价为+2价,Na2S4O6中S的化合价为+2.5价,所以Na2S2O3为反应物,Na2S4O6为生成物,根据化合价的升降总值相等,在Na2S4O6前配2,由S守恒,可知Na2S2O3前配4,Au2O3和Au2O前分别配1,再根据Na+守恒,则生成物中必定为NaOH,且配平系数为4,则H2O为反应物,在其前面配2,配平后的化学方程式为:Au2O3+4Na2S2O3+2H2O===Au2O+2Na2S4O6+4NaOH。
答案(1)Na2S2O3 H2O Na2S4O6 Au2O NaOH (2)Au Na2S2O3 (3)S指向Au(4e-) (4)1∶4