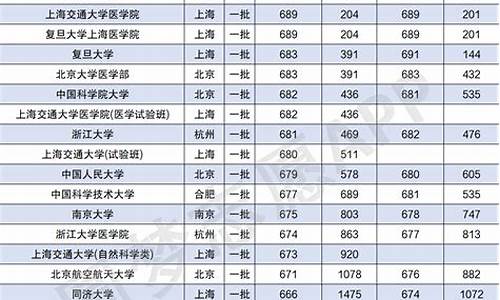
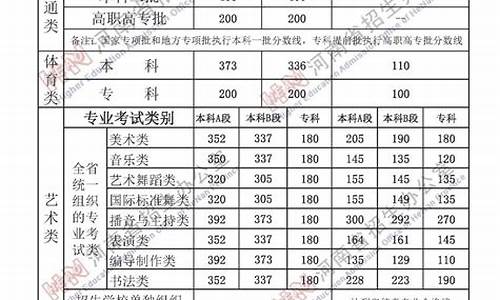
您现在的位置是: 首页 > 教育分析 教育分析
化学原电池高考题-高考化学电池例题解析
tamoadmin 2024-08-21 人已围观
简介1.关于一道较难的原电池的高中化学题目2.问一道高中化学题,电化学的题,谢谢3.高中化学问题关于原电池4.高中化学两道关于原电池的选择题5.化学原电池题,高考的关于一道较难的原电池的高中化学题目首先,Al在浓硫酸浓硝酸中钝化,产生致密的氧化膜,阻止了应,而且是原电池,故Cu溶解,Al附近产生红棕色的NO2。一段时间后硝酸变稀,稀硝酸可以和Al反应,而且Al的还原性要比Cu强,故Al溶解,在Cu极附
1.关于一道较难的原电池的高中化学题目
2.问一道高中化学题,电化学的题,谢谢
3.高中化学问题关于原电池
4.高中化学两道关于原电池的选择题
5.化学原电池题,高考的
关于一道较难的原电池的高中化学题目

首先,Al在浓硫酸浓硝酸中钝化,产生致密的氧化膜,阻止了应,而且是原电池,故Cu溶解,Al附近产生红棕色的NO2。一段时间后硝酸变稀,稀硝酸可以和Al反应,而且Al的还原性要比Cu强,故Al溶解,在Cu极附近产生红棕色气体NO2。
反应方程为:
开始:
Al极:2e-
+2NO3-
+4H+=2NO2+2H2O
Cu极:Cu-2e-=Cu2+
一段时间后:
Al极:2Al-6e-
=2Al
3+
Cu极:6NO3-+6e-+12H+=6H2O+6NO2。
解决楼主的追问
因为电子通过导线又铜流向铝,故电子在铝表面与硝酸根离子发生反应,反之亦然。
问一道高中化学题,电化学的题,谢谢
问题一:对于原电池来说电子有负极流向正极,但是电子有一个特点叫做“只走旱路不走水路”,也就是说电子只能通过导线,不能在溶液中移动,但a→b这一环节是在溶液中,电子走不了。
问题二:那个滤纸相当于连在原电池了,也就形成了电解池。所以滤纸上就相当于电解硫酸钠。
问题三:就是滤纸上的两个点,其中a点与负极连接,是阴极,b点与正极连接做阳极。
高中化学问题关于原电池
这是重庆高考题
当外电路通过1mol电子时,理论上负极消耗0.5mol铅生成0.5mol硫酸铅,而硫酸铅不溶解,是沉积在负极的,所以负极板增加的质量实际是0.5mol硫酸根的质量,1摩硫酸根96克,所以0.5摩为48克。
高中化学两道关于原电池的选择题
第一题选C
钢铁的腐蚀分两种 吸氧腐蚀和析氢腐蚀
铁变成亚铁离子 再变成铁离子 这时的铁离子是指氢氧化铁 作为弱碱的氢氧化铁不稳定分解为氧化铁 也就是铁锈了 1和4正确 (如果不考虑难溶物的电离平衡的话,也可以认为溶液中没有铁离子。)
吸氧腐蚀 氧气作为氧化剂被还原,2正确
析氢腐蚀 酸性条件下 产生氢气3正确
第二题选A啊
要用作原电池 至少要有电子的转移吧 第一个复分解反应 根本化合价都没变
化学原电池题,高考的
那应该是苯和氢气反应生成环己烷的 ?
你说的应该是这道题
本身这个反应没有完全发生 ?所以在阴极有部分氢气产生
阳极生成氧气 ?同时生成氢离子 ?氢离子转移到阴极与苯生成环己烷 ?但是没有百分百反应 ?所以会有部分氢离子得到电子生成氢气 ?所有最后排出的气体总量并不是10 mol
设定生成的环己烷为xmol ?则消耗的电子为6x ? 从阳极上可以算的转椅总电量是2.8×4=11.2 mol电子 ? 11,2-6x ?就是生成氢气转移的电子量 ?生成氢气的量也就是5.6-3x ?(2.4-x)/(10+5.6-3x)=10% ? 2.4-x 是排除气体中苯的物质的量 ?算出x=1.2 ?实际生成环己烷转椅的电量就是6×1.2 =7.2 ? 电效率就等于7.2÷11.2×100%≈64.3%